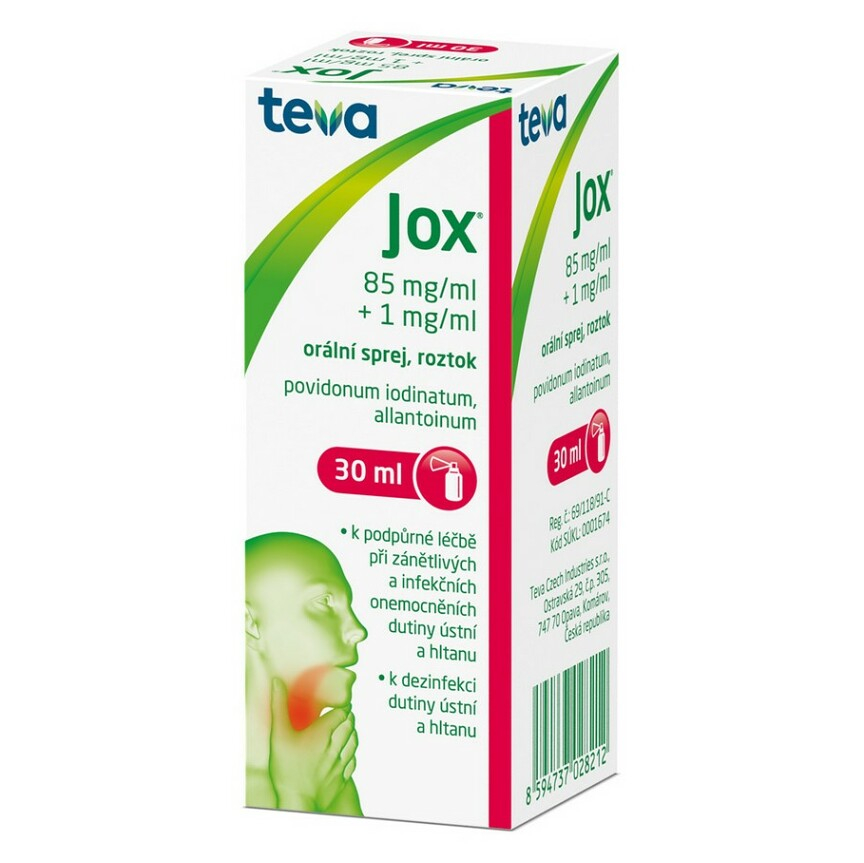
JOX - souhrn údajů a příbalový leták
Účinná látka: jodovanÝ povidon, alantoin
ATC skupina: R02AA15 - povidone-iodine
Obsah účinných látek: 85MG/ML+1MG/ML
Balení: Mechanický rozprašovač
sp.zn. sukls
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
Jox 85 mg/ml + 1 mg/ml orální sprej, roztok2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
povidonum iodinatum 85 mg, allantoinum 1 mg v 1 mlPomocné látky se známým účinkem: ethanol, propylenglykol
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Orální sprej, roztok.Čirá až slabě opalizující červenohnědá tekutina neomezeně se mísící s vodou.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Dezinfekce dutiny ústní a hltanu při zánětlivých a infekčních onemocněních – angínách, faryngitidách,tonzilofaryngitidách, tonzilitidách, glositidách, aftech; při chirurgických výkonech v dýchacích a
polykacích cestách – v přípravě pacienta před operační intervencí i v pooperační dlouhodobé péči; k
léčbě orálních infekcí vznikajících při chemoterapii. U streptokokových angín jako podpůrná léčba při
současné léčbě antibiotiky. Chřipková onemocnění při prvních prodromech.
Ústní sprej nesmí být podáván dětem do 8 let.
4.2 Dávkování a způsob podání
Dávkování
Dospělí, dospívající a děti od 8 let:
Orální sprej se obvykle aplikuje 2-4krát denně, v případě potřeby i častěji (po 4 hodinách) po 1-vstříknutích vpravo i vlevo nebo přímo na postižené místo. Mezi jednotlivými aplikacemi musí být
nejméně
hodiny. Rozprášený roztok se nevdechuje ani nepolyká! Maximálně je možno přípravek Jox sprej
aplikovat 6krát denně.
U starších pacientů a u pacientů s poruchou funkce jater není nutná úprava dávek.
Způsob podání:
Po sejmutí ochranného krytu se nasadí ústní aplikátor. Po vložení jeho konce do úst se při zavřených
ústech 2krát stiskne tlačítko rozprašovače tak, aby jedna dávka směrovala vpravo a druhá vlevo. Ústní
aplikátor se umývá z hygienických důvodů teplou vodou.
Pediatrická populace:
Přípravek Jox ústní sprej je u dětí ve věku do 8 let kontraindikován (viz bod 4.3).
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1. Při
hyperfunkci štítné žlázy, dekompenzované srdeční insuficienci, 2 týdny před a po plánovaném
vyšetření nebo terapii radioaktivním jódem a při poruše funkce ledvin.
Léčivá látka prochází placentou a přechází do mateřského mléka, proto se nesmí přípravek používat
v těhotenství a v období kojení.
Sprej nepodávat u dětí mladších 8 let, jelikož není jistota spolupráce při jeho aplikaci.
4.4 Zvláštní upozornění a opatření pro použití
U laryngitidy je přípravek možno používat jen v nezbytně nutných případech. S opatrností je třebapřípravek podávat u pacientů s poruchou funkce jater.
U pacientů s poruchou funkce jater í může dojít ke zvýšení transamináz a proto je nutné monitorovat
sérové hladiny těchto enzymů.
Přípravek obsahuje 18,6 % ethanolu.
Tento léčivý přípravek obsahuje v jedné dávce /vstřiku/ 24 mg propylenglykolu, což odpovídá 864 mg
propylenglykolu v maximální denní dávce /v 36 vstřicích/.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Přípravek se nemá kombinovat s jinými dezinficiencii dutiny ústní a hltanu, zejména s peroxidemvodíku (viz bod
4.4 Zvláštní upozornění a opatření pro použití).
Použití přípravku Jox může vyvolat falešně pozitivní výsledky Hematestu a Hemokult testu. Přitestování thyreoidálních funkcí může zvýšit hodnoty PBI.
4.6 Fertilita, těhotenství a kojení
TěhotenstvíV rámci preklinických studií provedených v zahraničí byly zjištěny DNA modifikující a mutagenní
účinky polyvidonu jódu. V pokusech na Salmonella typhimurium byly zaznamenány specifické změny
struktury DNA živých buněk. Při hodnocení embryotoxického účinku na amerických mořských
ježcích byly zjištěny vývojové abnormality embryí.
Zkušenosti s lokálním použitím jodovaného povidonu v dutině ústní a hltanu u těhotných žen nejsou.
Při vaginálním použití nebo lokální aplikaci na kůži v období těhotenství nebo během porodu byla u
novorozenců zjištěna kongenitální hypothyreóza nebo struma. Proto se přípravek Jox v těhotenství
nesmí podávat.
Kojení
Jód přechází do mateřského mléka. V krvi a moči kojenců byly zjištěny mnohonásobně vyšší
koncentrace jódu než u jejich matek, používajících jodovaný povidon. Vysoké sérové koncentrace
mohou způsobit hypofunkci štítné žlázy u kojenců. Z tohoto důvodu se přípravek Jox nesmí v období
kojení používat.
4.7 Účinky na schopnost řídit nebo obsluhovat stroje
Přípravek Jox nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Popisované nežádoucí účinky členěné podle systémově-orgánových tříd a frekvence výskytu:
Četnost je definována jako: velmi časté ( 1/10), časté ( 1/100 až < 1/10), méně časté ( 1/1000 až
< 1/100), vzácné ( 1/10 000 až < 1/1000) a velmi vzácné (< 1/10 000), není známo (z dostupných
údajů nelze určit).
Poruchy imunitního systému:
Velmi vzácné: anafylaktický šok
Gastrointestinální poruchy:
Méně časté: sucho v ústech
Poruchy kůže a podkožní tkáně:
Vzácné: kopřivka
Velmi vzácné: angioedém
Celkové poruchy a reakce v místě aplikace:
Méně časté: pálení v místě aplikace (převážně u dětí)
Poranění, otravy a procedurální komplikace:
Jodismus (kovová chuť, zvýšená salivace, otoky očí a hrtanu, plicní edém, kožní erupce,
gastrointestinální obtíže).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje
to pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické
pracovníky, aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 100 41 Praha Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Zkušenosti u zvířatPo požití jodovaného povidonu došlo k podráždění, ve výjimečných případech k poškození sliznice
gastrointestinálního traktu. Byla zaznamenána stenóza pyloru, nekróza žaludeční sliznice, peritonitida
a sepse.
Při inhalaci par jódu byla u zvířat pozorována deprese dýchání následkem otoku laryngu a hlasivkové
štěrbiny.
Zkušenosti u lidí
Zkušenosti s předávkováním při správném místním použití v dutině ústní nebo hltanu nejsou. Při
požití roztoku jódu však došlo k akutní otravě v důsledku korozivního a leptavého účinku jódu.
Zpočátku pacienti zaznamenali kovovou chuť v ústech, zvracení, bolest žaludku a průjem. Během
1-3 dnů se vyskytla anurie, edém hlasivkové štěrbiny vedoucí k asfyxii, aspirační pneumonie nebo
plicní edém. V některých případech došlo až k oběhovému selhání.
Léčba předávkování
Léčba je výlučně symptomatická a zpočátku se řídí standardními opatřeními vedoucími k zamezení
další absorpce z gastrointestinálního traktu. Postiženému se podává mléko a škrobový sliz. Pokud není
poškozen jícen, je možno provést výplach žaludku. Dále se podává aktivní uhlí a 1% nebo 5% roztok
thiosíranu sodného, který redukuje jód na jodid. Eliminaci absorbované látky je možno zvýšit
osmotickou diurézou. Zkušenosti s dialýzou nejsou v literatuře popsány.
Specifické antidotum neexistuje.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Krční léčiva, antiseptika.ATC kód: R02AAHlavní léčivou látkou je jodovaný povidon (PVP-jód). Je to dezinficiens ze skupiny jodoforů, které při
kontaktu s kůží a mukózními membránami uvolňují organický jód. Jód působí částečně baktericidně
na grampozitivní koky a bacily, na gramnegativní koky a bacily, na některé anaerobní baktérie a dále
působí na kvasinky či sacharomycety, protozoa a některé viry. Allantoin má protizánětlivé účinky a
tím spolupůsobí s jodovaným povidonem na terapeutickém účinku přípravku Jox.
Dezinfekční účinek jódu je výsledkem přímého působení na proteiny mikroorganismů.
5.2 Farmakokinetické vlastnosti
Při topické aplikaci jodovaného povidonu na intaktní kůži je absorpce jódu minimální. Při vaginálním
podání, aplikaci do úst a na porušenou kůži (těžké popáleniny) je systémová absorpce výraznější a
může dojít k interferenci s tyreoidálními funkcemi. Jód se v organismu konvertuje na jodidy, které se
koncentrují převážně ve štítné žláze. Jodidy, které nejsou zachyceny štítnou žlázou, jsou vylučovány
převážně renální cestou, v malém množství pak stolicí, slinami a potem. Procházejí rovněž placentou a
přecházejí do mateřského mléka.
5.3 Předklinické údaje vztahující se k bezpečnosti
V rámci preklinických studií, provedených v zahraničí, byly zjištěny DNA modifikující a mutagenníúčinky jodovaného povidonu. V pokusech na Salmonella typhimurium byly zaznamenány specifické
změny struktury DNA živých buněk. Při hodnocení embryotoxického účinku na amerických mořských
ježcích byly zjištěny vývojové abnormality embryí.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látekLevomenthol, monohydrát kyseliny citronové, dihydrát nátrium-citrátu, ethanol 96%, propylenglykol,
čištěná voda.
6.2 Inkompatibility
Jox je inkompatibilní s redukčními látkami, solemi alkaloidů a látkami s kyselou reakcí.
6.3 Doba použitelnosti
roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte při teplotě do 25 °C. Uchovávejte v původním obalu, aby byl přípravek chráněn před
světlem.
6.5 Druh obalu a velikost balení
Hnědá PET lahvička s obsahem 30 ml roztoku, mechanický ventil, kryt, ústní aplikátor, krabička.
Velikost balení: 30 ml
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Teva Czech Industries s.r.o., Ostravská 29, č.p. 305, 747 70 Opava, Komárov, Česká republika8. REGISTRAČNÍ ČÍSLA
69/118/91-C
9. DATUM PRNÍ REGISTRACE/ PRODLOUŽENÍ REGISTRACE
Datum první registrace: 15. 02. Datum posledního prodloužení registrace: 7.12.
10. DATUM REVIZE TEXTU
19. 1.
Jox Obalová informace
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALUJOX – KRABIČKA
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Jox 85 mg/ml + 1 mg/ml orální sprej, roztok
povidonum iodinatum, allantoinum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje povidonum iodinatum 85 mg a allantoinum 1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: propyl
Obalová informace - více
Více o léku Jox
Jox souhrn údajů
- Dávkování a způsob podání
- Kontraindikace
- Interakce
- Pro děti, pediatrická populace
- Fertilita, těhotenství a kojení
- Užívání po expiraci, upozornění a varování
- Schopnost řízení vozidel
- Předávkování
- Poločas rozpadu, Farmakokinetické vlastnosti
- Bezpečnost (v těhotenství)
- Vedlejší a nežádoucí účinky
- Obalová informace + Jox