MILGAMMA - souhrn údajů a příbalový leták
Účinná látka: benfotiamin, triturace kyanokobalaminu 0.5 %
ATC skupina: A11DB - vitamin b1 in combination with vitamin b6 and/or vita
Obsah účinných látek: 50MG/250MCG
Balení: Blistr
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
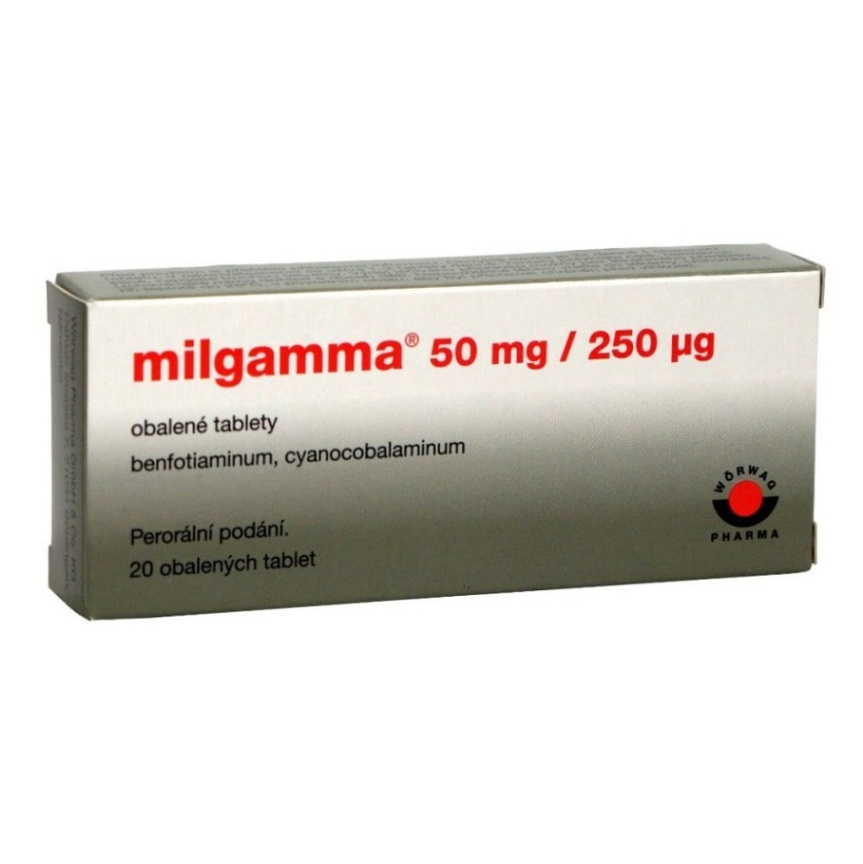
Milgamma 50 mg/250 g obalené tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
obalená tableta obsahuje benfotiamin 50 mg a kyanokobalamin 250 mikrogramů.
Pomocné látky se známým účinkem: hlinitý lak amarantu (E123), panenský ricinový olej, monohydrát
laktózy, tekutá glukóza usušená rozprášením sacharóza
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Obalená tableta.
Popis přípravku: fialovočervené kulaté lesklé obalené tablety čočkovitého tvaru.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Onemocnění periferního nervového systému různého původu, např. zánětlivá onemocnění periferních
nervů a kořenů, diabetická a alkoholická polyneuropatie, paréza n. facialis, neuralgie n. trigeminus,
radikulární syndromy, pásový opar apod. Dále při zvýšené potřebě vitamínů skupiny B.
4.2 Dávkování a způsob podání
Dávkování
Obvyklá dávka pro dospělého je třikrát denně jednu obalenou tabletu.
Jako roborans a v rekonvalescenci 1-2 obalené tablety Milgamma denně.
Přípravek Milgamma je určen pro dospělé.
Pediatrická populace
Bezpečnost a účinnost přípravku Milgamma u dětí nebyla dosud stanovena. Nejsou dostupné žádnéúdaje.
Způsob užívání
Obalené tablety se polykají celé, nerozkousané a zapíjejí se trochou tekutiny.
4.3 Kontraindikace
Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
4.4 Zvláštní upozornění a opatření pro použití
Pacienti trpící psoriázou mohou být léčeni přípravkem Milgamma pouze po přísném zvážení rizik,
protože kyanokobalamin může zhoršit kožní projevy.
Není vhodné podávat u pacientů s nádorovým onemocněním.
Tento léčivý přípravek obsahuje azobarvivo hlinitý lak amarantu (E123), které může způsobit
alergické reakce.
Přípravek dále obsahuje panenský ricinový olej, který může způsobit podráždění žaludku a průjem.
Milgamma obsahuje cukry sacharózu, laktózu a glukózu. Pacienti se vzácnými dědičnými problémy
s intolerancí galaktózy a fruktózy, hereditárním deficitem laktázy, se sacharózo-izomaltázovou
deficiencí nebo malabsorpcí glukózy a galaktózy nemají tento přípravek užívat.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Dosud nejsou žádné známy.
4.6 Fertilita, těhotenství a kojení
Přípravek může být podáván těhotným a kojícím ženám.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Milgamma nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
V některých případech může docházet k alergickým reakcím (kopřivka, vyrážka). V ojedinělých
případech může dojít k výraznému pocení, zrychlení srdeční frekvence, výskytu akné.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to
pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky,
aby hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 48
100 41 Praha 10
Webové stránky: http://www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Otravy nebo projevy předávkování nebyly dosud zaznamenány.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Vitaminy, vitamin B1 v kombinaci s vitaminem B6 a/nebo BATC kód: A11DB
Benfotiamin je dalším vývojovým produktem, aktivnějším derivátem vitamínu B1. Vyznačuje se
následujícími výhodami oproti tradičnímu vitamínu B1:
1. Benfotiamin je resorbován 3-5krát lépe než ekvivalentní množství aneurinhydrochloridu.
Resorbovatelné množství benfotiaminu se zvyšuje úměrně k aplikované dávce.
Aneurinhydrochloridu se podle nejnovějších poznatků vstřebá maximálně jen asi 10 mg.
2. Přeměna na kokarboxylázu, aktivní substanci při látkové výměně, je při užití benfotiaminu 3krát větší než po podání stejného množství vitamínu B1.
3. Benfotiamin je nesrovnatelně rezistentnější proti účinkům enzymu thiaminázy.
4. Po požití i velmi vysokých dávek benfotiaminu nebyly pozorovány žádné anafylaktické reakce.
5. Zatímco aneurinhydrochlorid působí proti peristaltice střev, má benfotiamin lehce povzbuzující
účinek na hladké svalstvo.
6. Benfotiamin je bez chuti a bez zápachu. Nepříjemný zápach, který je typický u klasického
vitamínu B1, se nevyskytuje.
Vitamín B12 je nepostradatelný pro buněčný metabolismus, normální tvorbu krve a fungování
nervového systému. Katalyzuje biologickou syntézu nukleových kyselin, a tím tvorbu nových
buněčných jader. Při vysokých dávkách má vitamín B12 kromě toho analgetické, antialergické
vlastnosti a účinky podporující prokrvení.
Zánětlivá a bolestivá onemocnění nervů jsou rychle ovlivňována kombinací účinných látek
obsažených v přípravku Milgamma. V obdobích zvýšené duševní a fyzické námahy, při nechutenství,
poruchách trávení, při poruchách krevního oběhu, při regeneraci organismu a obecně ve vyšším věku
se rovněž doporučuje zvýšené užívání benfotiaminu a vitamínu B12.
5.2 Farmakokinetické vlastnosti
Při pokusech na zvířatech bylo za pomoci mikroskopické autoradiografie zjištěno, že se benfotiaminvyznačuje nízkou permeabilitou a vysokou stabilitou. Po perorálním užití probíhá ve střevu působením
fosfatáz defosforylace na S-benzoylthiamin (SBT). Ten je rozpustný v lipidech a má proto vysokou
permeabilitu. SBT je resorbován bez podstatné přeměny na thiamin. Enzymatická debenzoylace na
thiamin probíhá až později, přičemž působením thiaminkinázy dochází k přeměně na kokarboxylázu.
V organismu je denně odbouráváno cca 1 mg thiaminu. Přebytek thiaminu je vylučován močí.
Absence dostatečného množství kokarboxylázy v krvi má za následek hromadění intermediárních
produktů odbourávání, jako pyruvátu, laktátu a ketoglutarátu v krvi a tkáních, na které reagují
obzvlášť citlivě svalstvo, myokard a CNS. Benfotiamin působí proti kumulaci těchto toxických látek.
Již jediná aplikace benfotiaminu prokazuje analgetický efekt.
Vitamín B12 uvolňovaný během procesu trávení potravy se váže na intrinsic faktor (IF). Tento
glykoprotein je tvořen parietálními buňkami žaludku. Komplex vitamínu B12 – IF je rezistentní vůči
proteolytickým enzymům a dostává se do distálního ilea, kde se váže na specifické receptory, čímž
dochází k resorpci vitamínu. Vitamín B12 je přiváděn mukózou ke kapilární cirkulaci, kde se váže na
transportní protein transkobalamin. Tento komplex je rychle přijímán játry, kostní dření a dalšími
proliferujícími buňkami.
Absorpce je narušena u pacientů s chybějícím intrinsic faktorem, u pacientů s malabsorpcí nebo
s onemocněními či malformacemi střeva, po gastroktomii nebo při vytváření autoimunních protilátek.
Z potravy se absorbuje zpravidla jen 1,5-3,5 g vitamínu B12.
Vitamín B12 je vylučován žlučníkem a podléhá enterohepatálnímu oběhu. Vitamín B12 přechází do
placenty.
Biologická dostupnost
Pro určení stavu vitamínu B1 jsou vhodná měření aktivit enzymů v erytrocytech v závislosti na TPP,
jako např. transketoláza a rozsah její reaktivity. Koncentrace v plazmě se pohybují mezi 2-g/100 ml.
Obvykle se koncentrace plazmy vitamínu B12 pohybují mezi 200-900 pg/ml, při nedostatku <
200 pg/ml. Cirkulující vitamín B1 odpovídá jen 0,1% celkového množství vitamínů.
Denní potřeba vitamínu B12 je cca 1 g. Vitamín B12 necirkulující v organismu se především ukládá
v játrech. Je-li „body-pool“ 3-5 mg, činí obsah v játrech 50-90%.
Resorpci vitamínu B12 brzdí kolchicin, ethanol a neomycin (zde se indikuje parenterální indikace).
Rovněž perorální antidiabetika typu biguanidu a kyseliny p-aminosalicylové, stejně jako
chloramphenikol a vitamín C interferují s resorpcí vitamínu B12.
Biologický poločas rozpadu cyanokobalaminu v plazmě je 123 hodin.
5.3 Předklinické údaje vztahující se k bezpečnosti
Z dostupné literatury ani po celá desetiletí terapeutického používání nevyplývají žádné náznaky na
mutagenní, karcinogenní nebo reprodukčně toxické vlastnosti benfotiaminu a vitamínu B12.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Monohydrát laktózy, sacharóza, kukuřičný škrob, želatina, mikrokrystalická celulóza, mastek, kyselina
stearová 95%, dextrin, tekutá glukóza usušená rozprášením, uhličitan vápenatý, šelak, panenský
ricinový olej, oxid titaničitý (E171), hlinitý lak amarantu (E123), bílý vosk, karnaubský vosk.
6.2 Inkompatibility
Benfotiamin nevykazuje z větší části inkompatibility charakteristické pro thiamin. Pouze v kombinaci
s aminofylinem, s vitamínem C a při vysokých teplotách nebo vysoké vlhkosti vzduchu a v kombinaci
s vitamínem B2 docházelo ke změnám barvy substance.
Vitamín B12 je nekompatibilní s oxidujícími a redukujícími látkami a se solemi těžkých kovů.
V roztocích obsahujících thiamin dochází vlivem produktů odbourávání thiaminu k rychlému rozkladu
vitamínu B12 a ostatních faktorů B-komplexu (nízké koncentrace iontů železa mohou před tímto jevem
poskytovat ochranu). Rovněž riboflavin především za současného působení světla působí destruktivně;
nikotinamid urychluje fotolýzu, zatímco antioxidanty působí opačně.
6.3 Doba použitelnosti
let
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
6.4 Druh obalu a obsah balení
PVC/PVDC/Al blistr, krabička.
20, 50 a 100 obalených tablet; klinická balení po 500, 1000 a 5000 obalených tablet.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku
Žádné zvláštní požadavky.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními
požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
Wörwag Pharma GmbH & Co., KG
Flugfeld-Allee 71034 Böblingen, Německo
8. REGISTRAČNÍ ČÍSLO
86/937/95-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 6. 12. Datum posledního prodloužení registrace: 15.4.
10. DATUM REVIZE TEXTU
2. 5.
Milgamma Obalová informace
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
krabička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Milgamma 50 mg/250 g obalené tablety
benfotiamin, kyanokobalamin
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jedna obalená tableta obsahuje 50 mg benfotiaminu a 250 mikrogramů kyanokobalaminu.
3. SEZNAM POMOCNÝCH LÁTEK
Přípravek ob
Obalová informace - více
Více o léku Milgamma
Milgamma souhrn údajů
- Dávkování a způsob podání
- Kontraindikace
- Interakce
- Pro děti, pediatrická populace
- Fertilita, těhotenství a kojení
- Užívání po expiraci, upozornění a varování
- Schopnost řízení vozidel
- Předávkování
- Poločas rozpadu, Farmakokinetické vlastnosti
- Bezpečnost (v těhotenství)
- Vedlejší a nežádoucí účinky
- Obalová informace + Milgamma