sp. zn. sukls246695/2021
a sp. zn. sukls
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
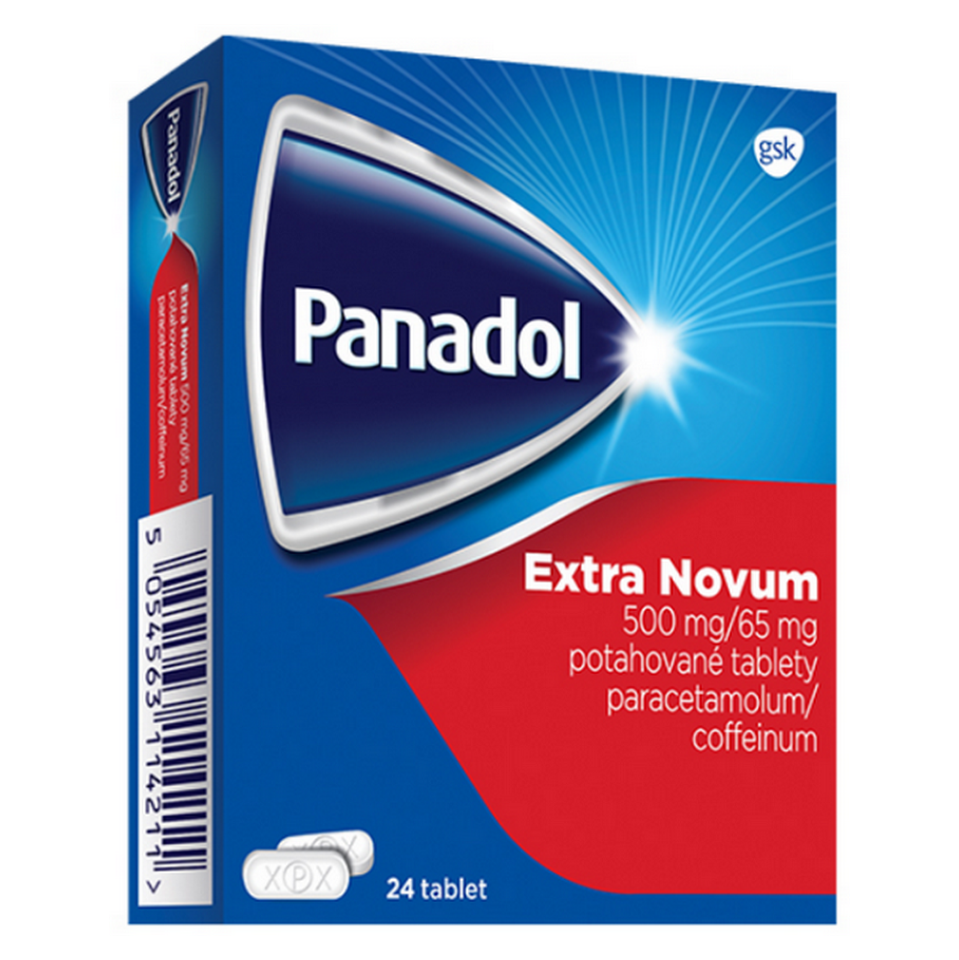
Panadol Extra Novum 500 mg/65 mg potahované tablety
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jedna potahovaná tableta obsahuje:
paracetamolum 500 mg
coffeinum 65 mg
Úplný seznam pomocných látek, viz bod 6.1.
3. LÉKOVÁ FORMA
Potahovaná tableta.
Bílé až téměř bílé, oválné potahované tablety, na jedné straně vyraženo „xPx“ (P je uvnitř kruhu) a na
druhé straně vyraženo „- -“.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Léčba mírné až středně silné bolesti, jako je bolest hlavy (včetně migrény), bolest zubů (včetně bolesti po
stomatologickém zákroku), neuralgie různého původu, menstruační bolest, bolest při revmatických
onemocněních (osteoartróza), bolest zad, bolest svalů a kloubů a bolest v krku při chřipce a akutním
zánětu horních cest dýchacích.
Panadol Extra Novum současně snižuje horečku.
4.2 Dávkování a způsob podání
Přípravek je určen k perorálnímu podání.
Tablety se mají zapít dostatečným množstvím tekutiny.
Pacient má užívat nejnižší účinnou dávku po nejkratší dobu nutnou ke zlepšení příznaků onemocnění.
Doporučené dávkování se nemá překračovat.
Časový odstup mezi jednotlivými dávkami musí být minimálně 4 hodiny.
Dospělí (včetně starších osob) a dospívající od 15 let
– 2 tablety podle potřeby až 4 x denně s časovým odstupem nejméně 4 hodiny.
Jedna tableta je určena pro pacienty s tělesnou hmotností 34 - 60 kg, 2 tablety u osob s tělesnou
hmotností nad 60 kg.
Nejvyšší jednotlivá dávka je 1 g paracetamolu (2 tablety). Maximální denní dávka je 8 tablet (4 g
paracetamolu a 0,52 g kofeinu).
Při dlouhodobé terapii (déle než 10 dnů) by dávka paracetamolu za 24 hodin neměla překročit 2,5 g.
Dospívající ve věku 12 – 15 let
tableta podle potřeby nejvýše 6 x denně v časovém odstupu nejméně 4 - 6 hodin.
Maximální jednotlivá dávka je 1 tableta.
Při souběžném užívání jiných léčivých přípravků s obsahem paracetamolu u dětí a dospívajících ve věku do
15 let a do 50 kg nemá celková denní dávka překročit 3 g paracetamolu (včetně tohoto přípravku)
v jakémkoli 24-hodinovém období.
Děti mladší 12 let
Panadol Extra Novum není určen pro děti do 12 let.
Pacienti s poruchou funkce ledvin
Pacienti s poruchou funkce ledvin se musí před zahájením léčby poradit s lékařem.
Při renální insuficienci je nutné dávkování upravit:
▪ při glomerulární filtraci 50 - 10 ml/min lze podávat 500 mg každých 6 hodin;
▪ při hodnotě nižší než 10 ml/min lze podávat 500 mg každých 8 hodin.
Pacienti s poruchou funkce jater
Pacienti s poruchou funkce jater se musí před zahájením léčby poradit s lékařem.
U pacientů s lehkou a středně těžkou poruchou funkce jater je třeba podávat tento přípravek s opatrností.
U pacientů s těžkou poruchou funkce jater je jeho podávání kontraindikováno.
4.3 Kontraindikace
▪ Hypersenzitivita na léčivé látky nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
▪ Těžká porucha funkce jater.
▪ Akutní hepatitida.
4.4 Zvláštní upozornění a opatření pro použití
Pacienty je třeba upozornit, aby neužívali současně jiné přípravky obsahující paracetamol. Souběžné
podávání by mohlo vést k předávkování.
Předávkování paracetamolem může způsobit selhání jater vedoucí až k potřebě transplantace jater nebo
smrti. U pacientů s onemocněním jater je nebezpečí předávkování vyšší. Základní onemocnění jater
zvyšuje riziko poškození jater v souvislosti s paracetamolem.
Po dobu léčby se nesmějí pít alkoholické nápoje. Dlouhodobá konzumace alkoholu významně zvyšuje
riziko paracetamolové hepatotoxicity, přičemž největší riziko se týká chronických alkoholiků, kteří před
užitím paracetamolu krátkodobě abstinují (kolem 12 hodin).
Paracetamol může být již v dávkách nad 6 – 8 g denně hepatotoxický. Jaterní poškození se však může
rozvinout i při nižších dávkách, pokud spolupůsobí alkohol, induktory jaterních enzymů nebo jiné
hepatotoxické léky.
Pacienti s diagnostikovanou poruchou funkce jater nebo ledvin se musí před zahájením užívání tohoto
léčivého přípravku poradit s lékařem.
Při podávání paracetamolu nemocným s lehkou a středně těžkou poruchou funkce jater a u pacientů, kteří
užívají dlouhodobě vyšší dávky paracetamolu, se doporučuje pravidelná kontrola jaterních testů.
Při dlouhodobé léčbě nelze vyloučit možnost poškození ledvin.
U pacientů s deplecí glutathionu, jako jsou významně podvyživení či anorektičtí pacienti, při velmi nízkém
BMI, chroničtí těžcí alkoholici nebo pacienti se sepsí, byly hlášeny případy poruchy funkce až selhání jater.
U stavů s deplecí glutathionu může použití paracetamolu zvyšovat riziko metabolické acidózy.
Paracetamol by měl být užíván se zvýšenou opatrností u hemolytické anemie, při deficitu enzymu glukóza-
6-fosfátdehydrogenázy a u nemocných s poruchou funkce ledvin (viz bod 4.2).
Při léčbě perorálními antikoagulancii a současném podávání vyšších dávek paracetamolu je nutná kontrola
protrombinového času.
Při užívaní přípravku Panadol Extra Novum je potřeba se vyhnout nadměrnému příjmu kofeinu. Pití
nepřiměřeného množství kávy nebo čaje spolu s užíváním tohoto přípravku může způsobit pocit napětí a
podrážděnosti.
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Rychlost absorpce paracetamolu může být zvýšena metoklopramidem nebo domperidonem a snížena
cholestyraminem.
Současné dlouhodobé užívání Panadolu Extra Novum a kyseliny acetylsalicylové (ASA) nebo dalších
nesteroidních protizánětlivých přípravků (NSAID) může vést k poškození ledvin.
Antikoagulační efekt warfarinu nebo jiných kumarinových přípravků může být zvýšen spolu se zvýšeným
rizikem krvácení dlouhodobým pravidelným denním užíváním paracetamolu. Občasné používání nemá
signifikantní efekt.
Hepatotoxické látky mohou zvýšit možnost kumulace a předávkování paracetamolem.
Paracetamol zvyšuje plazmatickou hladinu ASA a chloramfenikolu.
Probenecid ovlivňuje vylučování a koncentraci paracetamolu v plazmě.
Induktory mikrosomálních enzymů (rifampicin, fenobarbital) mohou zvýšit toxicitu paracetamolu vznikem
vyššího podílu toxického epoxidu při jeho biotransformaci.
Paracetamol může snížit biologickou dostupnost lamotriginu s možným snížením jeho účinku, z důvodu
možné indukce jeho metabolismu v játrech.
Současné podávání paracetamolu a zidovudinu zvyšuje riziko neutropenie.
Současné podávání paracetamolu a isoniazidu zvyšuje riziko hepatotoxicity.
Kofein může zvyšovat eliminaci lithia z organismu. Současné použití se proto nedoporučuje.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Studie u zvířat ani u člověka nenaznamenaly žádné riziko paracetamolu s ohledem na těhotenství nebo
embryofetální vývoj.
Kombinace paracetamolu s kofeinem se v průběhu těhotenství nedoporučuje pro možné zvýšení rizika
spontánního potratu spojeného s konzumací kofeinu.
Kojení
Paracetamol i kofein se vylučují do mateřského mléka.
Ačkoli se paracetamol vylučuje do mateřského mléka, studie u člověka nezaznamenaly žádné riziko
s ohledem na kojení nebo pro kojené dítě.
Kofein v mateřském mléku může mít potenciálně stimulační efekt na kojené dítě, ale signifikantní toxicita
nebyla pozorována.
Fertilita
Nejsou dostupné odpovídající údaje.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Přípravek nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Anamnestická data z klinických studií nejsou dostatečná, proto jsou data o nežádoucích účincích
čerpána převážně z post-marketingových zkušeností. Nežádoucí účinky jsou seřazeny podle tříd
orgánových systémů a frekvence výskytu.
Frekvence výskytu jsou definovány takto: velmi časté (≥ 1/10); časté (≥ 1/100 až < 1/10); méně časté
(≥ 1/1 000 až < 1/100); vzácné (≥ 1/10 000 až < 1/1 000); velmi vzácné (< 1/10 000); není známo
(z dostupných údajů nelze určit).
Frekvence nežádoucích účinků spojených s paracetamolem a kofeinem je uvedena v následující tabulce
podle tříd orgánových systémů:
Paracetamol
Systém Frekvence Nežádoucí účinky
Poruchy krve a
lymfatického systému vzácné
trombocytopenie, neutropenie, leukopenie,
agranulocytóza, pancytopenie*
Respirační, hrudní a
mediastinální poruchy vzácné
bronchospazmus u pacientů s přecitlivělostí
na kyselinu acetylsalicylovou nebo jiná NSAID
Poruchy imunitního
systému vzácné
anafylaxe
kožní hypersenzitivní reakce včetně kožní
vyrážky a angioedému
Poruchy kůže a podkožní
tkáně
vzácné svědení, vyrážka, pocení, purpura, kopřivka
velmi vzácné
závažné kožní reakce (Stevensův-Johnsonův
syndrom, toxická epidermální nekrolýza a
akutní generalizovaná exantematózní
pustulóza)
Srdeční poruchy vzácné edém
Cévní poruchy vzácné edém
Poruchy jater a
žlučových cest vzácné
abnormální jaterní funkce*, selhání jater,
nekróza jater, ikterus
Gastrointestinální
poruchy vzácné bolest břicha, průjem, nauzea, zvracení
Kofein**
Systém Frekvence Nežádoucí účinky
Poruchy nervového
systému není známo závrať, bolest hlavy
Srdeční poruchy není známo palpitace
Psychické poruchy není známo nespavost, neklid, úzkost a podrážděnost, nervozita
Gastrointestinální
poruchy není známo gastrointestinální poruchy
* Zřídka se mohou objevit poruchy krvetvorby a reverzibilní zvýšení funkčních testů jater (AST, ALT,
GMP), AP a bilirubinu.
** Pokud je přípravek Panadol Extra Novum kombinován s kofeinem v potravě (v nápojích ap.), zvyšuje
se pravděpodobnost výskytu nežádoucích účinků kofeinu. Nejčastější nežádoucí účinek kofeinu je
nauzea způsobená podrážděním gastrointestinálního traktu.
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to
pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky, aby
hlásili podezření na nežádoucí účinky na adresu:
Státní ústav pro kontrolu léčiv
Šrobárova 100 41 Praha webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek
4.9 Předávkování
Paracetamol
Předávkování paracetamolem může mít za následek závažné poškození jater končící transplantací jater až
úmrtím. Předávkování může někdy vyvolat akutní renální tubulární nekrózu. Spolu s poruchou funkce jater
nebo jaterní toxicitou byla pozorovaná akutní pankreatitida. Do 24 hodin se může objevit nauzea,
zvracení, letargie a pocení. Bolest břicha může být prvním příznakem jaterního poškození, které se
obyčejně projevuje za 1 – 2 dny. Zkušenosti s předávkováním paracetamolem ukazují, že poškození jater
obyčejně vrcholí po 4 – 6 dnech. Může dojít k jaternímu selhání, encefalopatii, kómatu až úmrtí.
Komplikace selhání jater představuje acidóza, edém mozku, krvácivé projevy, hypoglykémie, hypotenze,
infekce a renální selhání. Prodloužení protrombinového času je indikátorem zhoršení funkce jater, a proto
se doporučuje jeho monitorování. Pacienti, kteří užívají induktory enzymů (karbamazepin, fenytoin,
barbituráty, rifampicin) nebo mají abúzus alkoholu v anamnéze, jsou více náchylní k poškození jater.
K akutnímu renálnímu selhání může dojít i bez přítomnosti závažného poškození jater. Jiným projevem
intoxikace je poškození myokardu.
Léčba předávkování: V případě předávkování paracetamolem je nezbytná okamžitá lékařská pomoc, i když
nejsou přítomny žádné příznaky předávkování. Je nutná hospitalizace a vyvolání zvracení, výplach žaludku
(zvláště byl-li paracetamol požit před méně než 4 hodinami), poté je nutné podat methionin (2,5 g p.o.) a
dále jsou vhodná podpůrná opatření. Podání aktivního uhlí z důvodů snížení gastrointestinální absorpce je
sporné. Doporučuje se monitorování plazmatické koncentrace paracetamolu. Specifické antidotum
acetylcystein se má podat do 8 - 15 hodin po otravě, příznivé účinky však byly pozorovány i při pozdějším
podání. U velmi těžkých otrav je možná hemodialýza či hemoperfúze.
Kofein
Vysoké dávky kofeinu mohou vyvolat bolesti v epigastriu, zvracení, diurézu, tachykardii nebo srdeční
arytmii, stimulaci CNS (nespavost, neklid, excitaci, agitovanost, nervozitu, třes a křeče).
Je však třeba si uvědomit, že klinicky výzmamné symptomy předávkování kofeinem z tohoto přípravku by
byly spojeny se závažnou jaterní toxicitou požitého paracetamolu.
Léčba předávkování: K dispozici není specifické antidotum, lze zavést podpůrná opatření, jako podání
betablokátorů ke zvrácení kardiotoxických účinků.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: Paracetamol, kombinace kromě psycholeptik.
ATC skupina: N02BE
Paracetamol
Paracetamol je analgetikum a antipyretikum bez protizánětlivého účinku a s dobrou gastrointestinální
snášenlivostí (nedráždí žaludek). Je vhodný u dospělých pacientů i v pediatrii. Mechanismus účinku je
pravděpodobně závislý na inhibici syntézy prostaglandinů v centrálním nervovém systému.
Absence periferní inhibice prostaglandinů dává paracetamolu důležité farmakologické vlastnosti, jako jsou
udržení protektivních prostaglandinů v gastrointestinálním traktu. Paracetamol je proto vhodný zejména
u pacientů s anamnézou onemocnění trávicího traktu nebo pacientů užívajících další medikaci, kde je
inhibice periferních prostaglandinů nežádoucí (jako např. pacienti s anamnézou gastrointestinálního
krvácení nebo starší pacienti).
Paracetamol neovlivňuje glykémii a je vhodný u diabetiků. Neovlivňuje krevní srážlivost při užívání dávek
paracetamolu do 2 g denně nebo při krátkodobém užívání, nemá vliv na hladinu kyseliny močové a její
vylučování do moči. Paracetamol lze podat ve všech případech, kde jsou kontraindikovány salicyláty.
Kofein
Kofein zvyšuje analgetický účinek paracetamolu tím, že působí stimulačně na centrální nervový systém a
může tak zmírnit depresi, která je často s bolestí spojená.
Metaanalýza 30 klinických studií kombinovaných analgetik s kofeinem zahrnující šest studií kombinace
různých dávek paracetamolu s kofeinem ukázala, že kombinace paracetamolu s kofeinem je 1,37-krát
účinnější než samotný paracetamol (p < 0,05).
5.2 Farmakokinetické vlastnosti
Paracetamol
Paracetamol je rychle a téměř úplně vstřebáván z gastrointestinálního traktu. Paracetamol je relativně
rovnoměrně distribuován do většiny tělesných tkání. Vazba na plasmatické bílkoviny je minimální při
terapeutických koncentracích.
Paracetamol je metabolizován v játrech a vylučován ledvinami ve formě glukuronidových a sulfátových
konjugátů. Méně než 5 % paracetamolu se vyloučí v nezměněné formě.
Při závažné jaterní insuficienci dochází k prodloužení biologického poločasu až na 5 hodin. Při insuficienci
ledvin se poločas neprodlužuje, ale protože vázne vylučování ledvinami, je třeba dávku paracetamolu
redukovat.
Panadol Extra Novum obsahuje kyselinu alginovou a uhličitan vápenatý (technologie Optisorb) pro
zlepšení vstřebávání. Koncentrace v plazmě dosahuje vrcholu za 30 až 60 minut po podání per os.
Farmakokinetické údaje u lidí ukazují, že paracetamol je v plazmě detekovatelný po 10 minutách.
Biologický poločas v plasmě po perorálním podání je 1 - 4 hodiny (průměrně 2,3 hodiny).
Kofein
Kofein je po perorální aplikaci rychle absorbován a distribuován do tělesných tkání. Maximální
koncentrace v plasmě dosahuje vrcholu během 1 hodiny po užití per os. Průměrný plazmatický poločas po
perorálním podání je přibližně 4,9 hodiny. Kofein je téměř úplně metabolizován v játrech oxidací a
demetylací na různé xantinové deriváty, které jsou vylučovány do moči.
5.3 Předklinické údaje vztahující se k bezpečnosti
Předklinické údaje týkající se bezpečnosti neodhalily žádný důkaz teratogenity, mutagenity nebo
kancerogenity po podání obou léčivých látek.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Předbobtnalý kukuřičný škrob, povidon K 25, uhličitan vápenatý, kyselina alginová, mikrokrystalická
celulóza, krospovidon, magnesium-stearát, čištěná voda
potahová vrstva: potahová soustava Opadry YS-1-7003 bílá (obsahuje oxid titaničitý (E 171), hypromelosu
2910/3, hypromelosu 2010/6, makrogol 400, polysorbát 80), karnaubský vosk (leštidlo)
6.2 Inkompatibility
Neuplatňuje se.
6.3 Doba použitelnosti
roky
6.4 Zvláštní opatření pro uchovávání
Uchovávejte mimo dohled a dosah dětí.
Uchovávejte při teplotě do 30 °C.
6.5 Druh obalu a obsah balení
10, 24 a 30 tablet: blistr (neprůhledný PP/PP), krabička.
10, 20, 24 a 30 tablet: blistr (neprůhledný PVC/dvouvrstvá bezpečnostní Al/PET fólie), krabička
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zklikvidován v souladu s místními požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Consumer Healthcare Czech Republic s.r.o.
Hvězdova 1734/2c, 140 00 Praha 4 - Nusle, Česká republika
8. REGISTRAČNÍ ČÍSLO
07/495/13-C
9. DATUM PRVNÍ REGISTRACE / PRODLOUŽENÍ REGISTRACE
Datum první registrace: 18. 1.
10. DATUM REVIZE TEXTU
1. 7.