RECREOL -
Bahan aktif:
Kumpulan ATC: D03AX03 - dexpanthenol
Kandungan bahan aktif: 50MG/G
Pembungkusan: Tube
Sp. zn. sukls
SOUHRN ÚDAJŮ O PŘÍPRAVKU
1. NÁZEV PŘÍPRAVKU
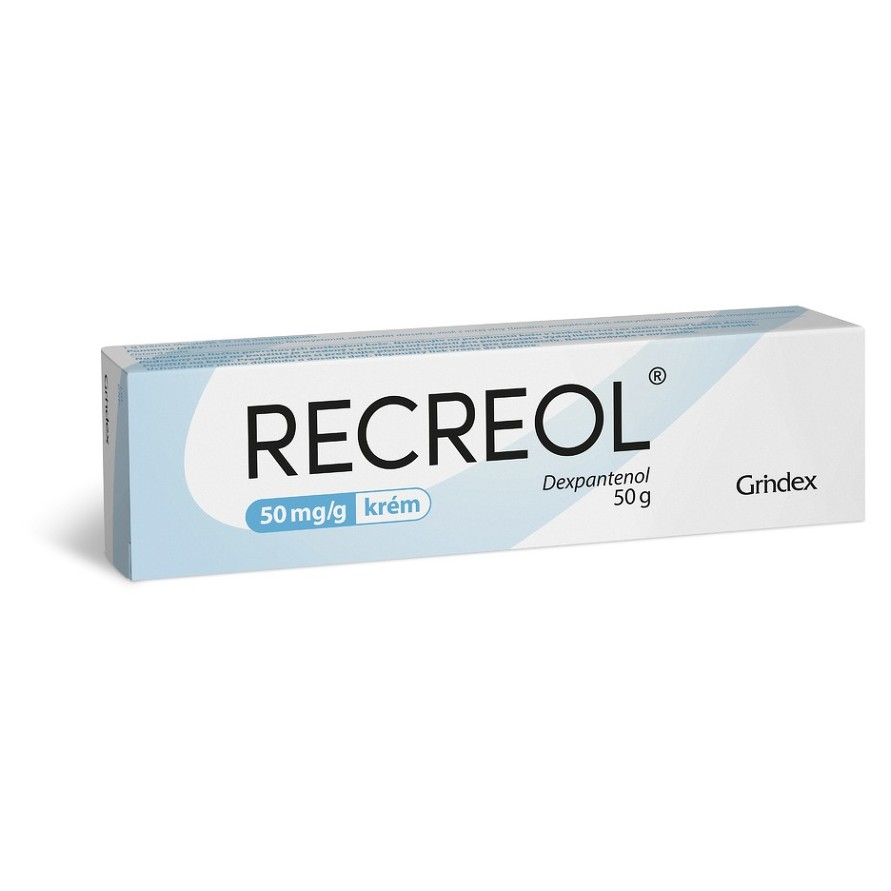
Recreol 50 mg/g krém
2. KVALITATIVNÍ A KVANTITATIVNÍ SLOŽENÍ
Jeden gram krému obsahuje dexpanthenolum 50 mg.
Pomocné látky se známým účinkem: jeden gram krému obsahuje 15 mg propylenglykolu, 13 mg tuku
z ovčí vlny, 24 mg cetylalkoholu a 16 mg stearylalkoholu.
Úplný seznam pomocných látek viz bod 6.1.
3. LÉKOVÁ FORMA
Krém.
Homogenní bílý nebo nažloutlý krém s charakteristickým zápachem.
4. KLINICKÉ ÚDAJE
4.1 Terapeutické indikace
Podpůrná léčba povrchových kožních lézí různého původu zprostředkovaná zvlhčením epidermální
bariéry, podporující epitelizaci s následnými protizánětlivými a protisvědivými účinky.
4.2 Dávkování a způsob podání
Dávkování
Pokud není doporučeno jinak, dexpanthenol se u dospělých a dětí aplikuje v tenké vrstvě na
postiženou kůži jednou až několikrát denně.
Délka léčby závisí na povaze a průběhu onemocnění.
Pacienti mají být poučeni, aby se poradili s lékařem, pokud se po 14 dnech používání přípravku necítí
lépe nebo pokud se jim přitíží.
Většina studií lokálních účinků dexpanthenolu byla krátkodobá, obvykle 3-4 týdny.
Pediatrická populace
Dexpanthenol lze používat v pediatrické populaci.Pacienti s poruchou funkce ledvin a jater
U pacientů s poruchou funkce ledvin a jater nebyly provedeny žádné studie.
Starší pacienti
U starších pacientů (65 let a starší) nebyly provedeny žádné studie.
Způsob podání
Kožní podání.
4.3 Kontraindikace
− Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku uvedenou v bodě 6.1.
− Aplikace na rány u pacientů s hemofilií kvůli riziku závažného krvácení.
4.4 Zvláštní upozornění a opatření pro použití
Je nutné vyhnout se kontaktu dexpanthenolu s očima.
Dexpanthenol má být vysazen, pokud se během používání objeví známky hypersenzitivity.
Recreol obsahuje propylenglykol – může způsobit podráždění kůže.
Recreol obsahuje cetylalkohol, stearylalkohol a tuk z ovčí vlny – může způsobit místní kožní reakce
(např. kontaktní dermatitidu).
4.5 Interakce s jinými léčivými přípravky a jiné formy interakce
Studie interakcí s dexpanthenolem nebyly provedeny. Nejsou známy žádné interakce. Neexistuje
žádný důkaz interakce lokálně aplikovaného dexpanthenolu s jakýmikoli léčivými přípravky.
4.6 Fertilita, těhotenství a kojení
Těhotenství
Možný účinek dexpanthenolu na reprodukci nebyl studován. Údaje týkající se použití dexpanthenolu
u těhotných žen nejsou k dispozici. Studie na zvířatech neprokazují přímé ani nepřímé škodlivé účinky
s ohledem na reprodukční toxicitu. Avšak během těhotenství lze dexpanthenol používat pouze se
souhlasem lékaře.
Kojení
Protože je systémová expozice dexpanthenolu u kojící ženy zanedbatelná, neočekávají se žádné
účinky na novorozence/kojence. Přípravek Recreol lze v období kojení používat, ale je třeba se
vyvarovat lokálnímu použití v oblasti prsou, aby se zabránilo kontaktu s ústy dítěte.
Fertilita
S dexpanthenolem nebyly provedeny žádné studie účinku na fertilitu člověka. Případné účinky na
vyvíjející se plod nejsou známy.
4.7 Účinky na schopnost řídit a obsluhovat stroje
Dexpanthenol nemá žádný vliv na schopnost řídit nebo obsluhovat stroje.
4.8 Nežádoucí účinky
Nežádoucí účinky jsou seřazeny podle tříd orgánových systémů s použitím následující konvence:
velmi časté (≥1/10), časté (≥1/100 až <1/10), méně časté (≥1/1000 až <1/100), vzácné
(≥1/10000 až <1/1000), velmi vzácné (<1/10000), není známo (z dostupných údajů nelze
určit).
Poruchy imunitního systému
Velmi vzácné: alergické reakce.
Poruchy kůže a podkožní tkáně
Velmi vzácné: hypersenzitivní reakce (např. zánět kůže/alergické kožní reakce a podráždění
kůže).
Hlášení podezření na nežádoucí účinky
Hlášení podezření na nežádoucí účinky po registraci léčivého přípravku je důležité. Umožňuje to
pokračovat ve sledování poměru přínosů a rizik léčivého přípravku. Žádáme zdravotnické pracovníky,
aby hlásili podezření na nežádoucí účinky na adresu Státní ústav pro kontrolu léčiv, Šrobárova 48,
100 41 Praha 10, webové stránky: www.sukl.cz/nahlasit-nezadouci-ucinek.
4.9 Předávkování
Nejsou k dispozici žádné údaje o předávkování u lidí. I v případě nekonvenčního použití nadměrného
množství má dexpanthenol nízkou systémovou toxicitu a nezpůsobuje žádné nežádoucí účinky, které
by byly nebezpečné pro zdraví pacienta.
5. FARMAKOLOGICKÉ VLASTNOSTI
5.1 Farmakodynamické vlastnosti
Farmakoterapeutická skupina: přípravky pro léčbu ran a vředů, jiná léčiva podporující tvorbu jizev.
ATC kód: D03AX
Dexpanthenol je v tkáních přeměněn na kyselinu pantothenovou, složku koenzymu A (CoA), která je
nezbytná pro normální funkci epitelu, zvyšuje proliferaci fibroblastů a urychluje reepitelizaci při
hojení ran.
Tento proces buněčného dělení a tvorby nové kožní tkáně obnovuje elasticitu kůže a podporuje hojení
ran.
5.2 Farmakokinetické vlastnosti
Absorpce
Studie s panthenolem značeným tritiem prokázaly, že se látka vstřebává kůží.
Biotransformace
Po absorpci je dexpanthenol snadno přeměněn na kyselinu pantothenovou, která je široce
distribuována do tělesných tkání, zejména jako koenzym A.
Distribuce
Kyselina pantothenová se váže na plazmatické proteiny (hlavně β-globuliny a albumin). U zdravých
dospělých jedinců byly ve volné krvi, resp. v krevním séru detekovány koncentrace přibližně 1 000 μg/l a 100 μg/l.
Eliminace
Kyselina pantothenová se v těle nerozkládá, proto se vylučuje v nezměněné formě. Po perorálním
podání je asi 60 až 70 % vylučováno močí a zbytek ve stolici. Dospělí vyloučí močí 2-7 mg kyseliny
pantothenové za den, děti 2-3 mg.
5.3 Předklinické údaje vztahující se k bezpečnosti
Akutní toxicita
Panthenol, kyselina pantothenová a její soli jsou považovány za netoxické.
LD50 dexpanthenolu podaného perorálně myši je 15 g/kg. Ve dvou jiných studiích sledujících akutní
toxicitu po perorálním podání dexpanthenolu nedošlo po dávce 10 g/kg ani k jednomu úhynu zvířete
a po dávce 20 g/kg došlo k úhynu všech zvířat.
Subakutní toxicita
Po denní perorální dávce 20 mg dexpanthenolu podávané potkanům a dávce 500 mg/den podávané
psům po dobu 3 měsíců nebyly zaznamenány toxické účinky nebo histopatologické změny.
Perorální dávky dexpanthenolu byly podávány 24 potkanům po dobu 6 měsíců; byly podávány dávky
mg dexpanthenolu denně. Nebyly hlášeny žádné histopatologické změny.
Po denním podávání 50 mg/kg kalcium-pantothenátu po dobu 6 měsíců psům a 1 g kalcium-
pantothenátu po dobu 6 měsíců opicím nebyly prokázány žádné toxické příznaky ani histopatologické
změny.
6. FARMACEUTICKÉ ÚDAJE
6.1 Seznam pomocných látek
Racemický pantolakton
Fenoxyethanol
Draselná sůl cetyl-fosfátu
Tuk z ovčí vlny
Propylenglykol
Stearylalkohol
Cetylalkohol
Isopropyl-myristát
Čištěná voda
6.2 Inkompatibility
Neexistují žádné informace o možných inkompatibilitách.
6.3 Doba použitelnosti
roky
6.4 Zvláštní opatření pro uchovávání
Tento léčivý přípravek nevyžaduje žádné zvláštní podmínky uchovávání.
Chraňte před mrazem.
6.5 Druh obalu a obsah balení
30 g nebo 50 g krému v hliníkové tubě s vnitřní vrstvou fenolepoxidového laku a těsnící hmotou
v ohybu. Tuba je uzavřena hliníkovou membránou a je opatřena bílým HDPE šroubovacím uzávěrem.
Hliníková tuba je uložena v krabičce.
Na trhu nemusí být všechny velikosti balení.
6.6 Zvláštní opatření pro likvidaci přípravku a pro zacházení s ním
Žádné zvláštní požadavky na likvidaci.
Veškerý nepoužitý léčivý přípravek nebo odpad musí být zlikvidován v souladu s místními
požadavky.
7. DRŽITEL ROZHODNUTÍ O REGISTRACI
AS GRINDEKS.
Krustpils iela 53, Rīga, LV-1057, Lotyšsko
Tel.: +371 Fax: +371 E-mail: grindeks@grindeks.lv
8. REGISTRAČNÍ ČÍSLO(A)
46/495/18-C
9. DATUM PRVNÍ REGISTRACE/PRODLOUŽENÍ REGISTRACE
Datum první registrace: 19. 6.
10. DATUM REVIZE TEXTU
30. 11.
Recreol
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALU
Krabička
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
RECREOL 50 mg/g krém
dexpanthenolum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden gram krému obsahuje dexpanthenolum 50 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: racemický pantolakton, fenoxyethanol, draselná sůl cetyl-fosfátu