Otrivin
ÚDAJE UVÁDĚNÉ NA VNĚJŠÍM OBALUKrabička
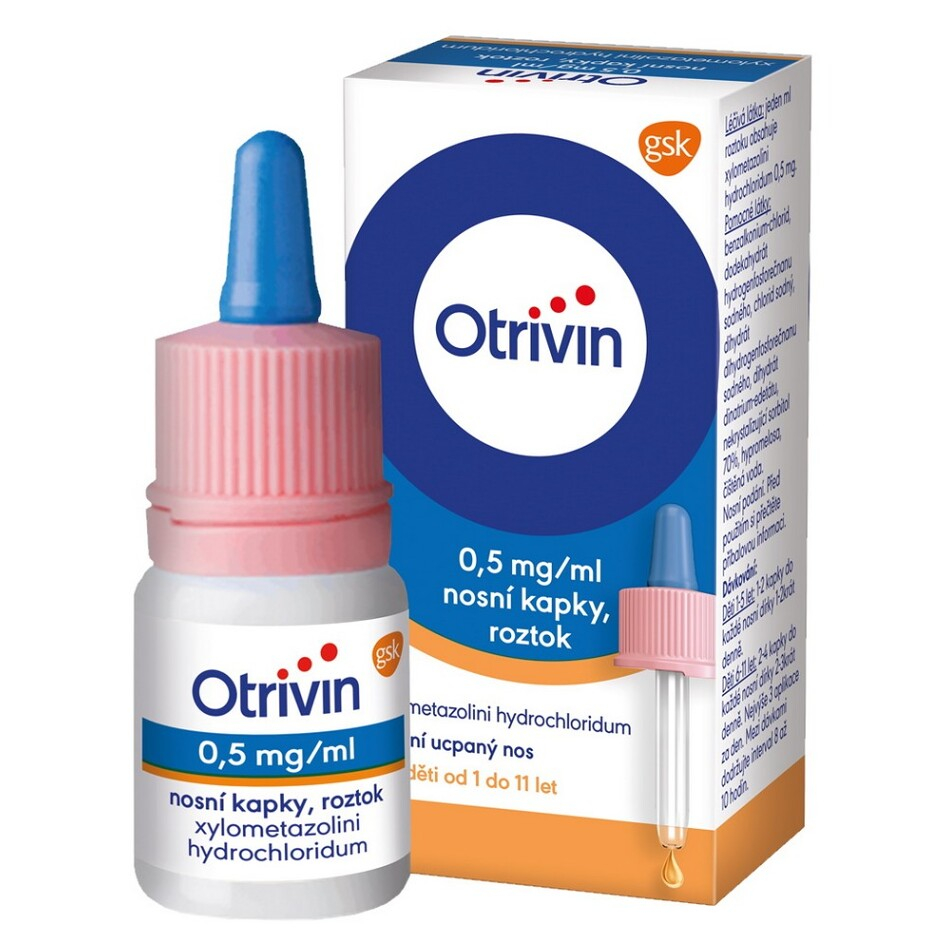
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU
Otrivin 1 mg/ml nosní sprej, roztok
xylometazolini hydrochloridum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Léčivá látka: jeden ml roztoku obsahuje xylometazolini hydrochloridum 1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
Pomocné látky: benzalkonium-chlorid, dodekahydrát hydrogenfosforečnanu sodného, chlorid
sodný, dihydrát dihydrogenfosforečnanu sodného, dihydrát dinatrium-edetátu, nekrystalizující
sorbitol 70%, hypromelosa, čištěná voda.
4. LÉKOVÁ FORMA A OBSAH BALENÍ
nosní sprej, roztok
10 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Nosní podání.
Před použitím si přečtěte příbalovou informaci.
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A
DOSAH DĚTÍ
Uchovávejte mimo dohled a dosah dětí.
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
Použitelné do:
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU
Z NICH, POKUD JE TO VHODNÉ
Nepoužitelné léčivo vraťte do lékárny
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Consumer Healthcare Czech Republic s.r.o.
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
Reg.č.: 69/220/01-C
13. ČÍSLO ŠARŽE
č. š.:
14. KLASIFIKACE PRO VÝDEJ
Výdej léčivého přípravku možný bez lékařského předpisu.
15. NÁVOD K POUŽITÍ
Pro dospělé a dospívající od 12 let
Uvolní ucpaný nos
Dávkování:
Dospělí a dospívající od 12 let: 1 vstřik do každé nosní dírky 1–3krát denně. Nejvýše 3 aplikace do
každé nosní dírky denně.
16. INFORMACE V BRAILLOVĚ PÍSMU
otrivin 1 mg/ml sprej
17. JEDINEČNÝ IDENTIFIKÁTOR – 2D ČÁROVÝ KÓD
Neuplatňuje se.
18. JEDINEČNÝ IDENTIFIKÁTOR – DATA ČITELNÁ OKEM
Neuplatňuje se.
ÚDAJE UVÁDĚNÉ NA VNITŘNÍM OBALU
Štítek na lahvičku
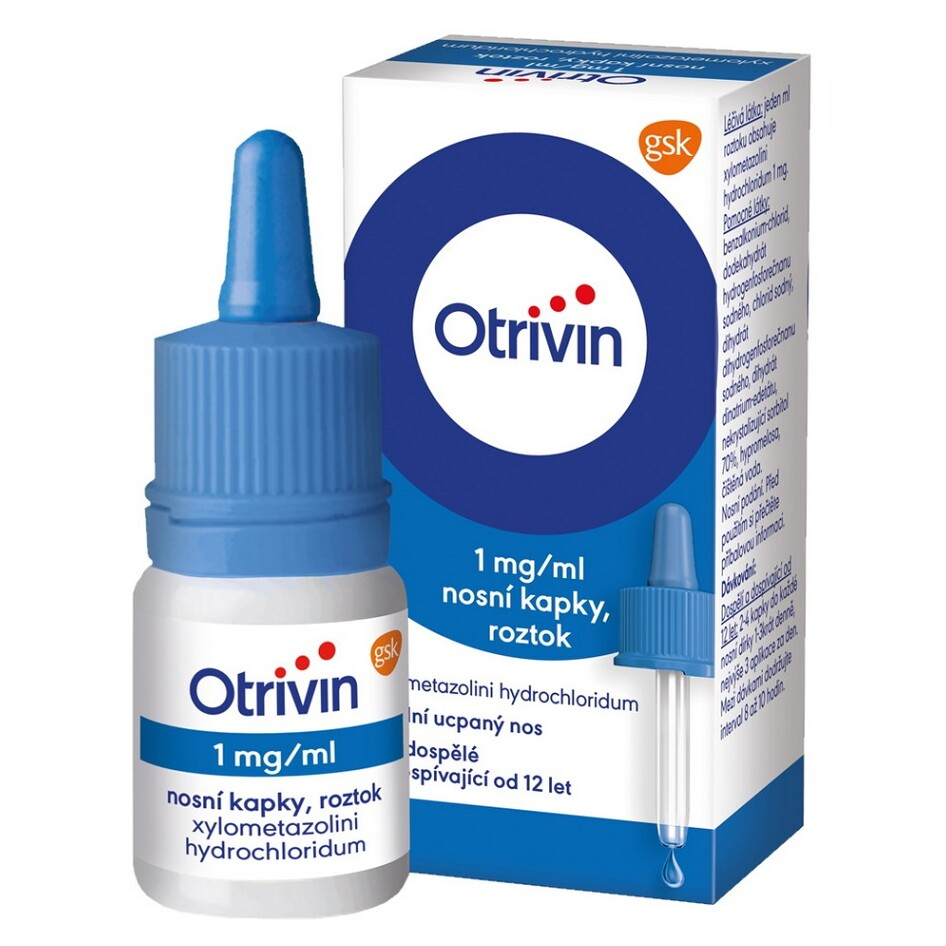
1. NÁZEV LÉČIVÉHO PŘÍPRAVKU A CESTA PODÁNÍ
Otrivin 1 mg/ml nosní sprej, roztok
xylometazolini hydrochloridum
2. OBSAH LÉČIVÉ LÁTKY/LÉČIVÝCH LÁTEK
Jeden ml roztoku obsahuje xylometazolini hydrochloridum 1 mg.
3. SEZNAM POMOCNÝCH LÁTEK
4. LÉKOVÁ FORMA A OBSAH BALENÍ
10 ml
5. ZPŮSOB A CESTA/CESTY PODÁNÍ
Nosní podání
6. ZVLÁŠTNÍ UPOZORNĚNÍ, ŽE LÉČIVÝ PŘÍPRAVEK MUSÍ BÝT UCHOVÁVÁN MIMO DOHLED A
DOSAH DĚTÍ
7. DALŠÍ ZVLÁŠTNÍ UPOZORNĚNÍ, POKUD JE POTŘEBNÉ
8. POUŽITELNOST
EXP
9. ZVLÁŠTNÍ PODMÍNKY PRO UCHOVÁVÁNÍ
10. ZVLÁŠTNÍ OPATŘENÍ PRO LIKVIDACI NEPOUŽITÝCH LÉČIVÝCH PŘÍPRAVKŮ NEBO ODPADU Z
NICH, POKUD JE TO VHODNÉ
11. NÁZEV A ADRESA DRŽITELE ROZHODNUTÍ O REGISTRACI
GlaxoSmithKline Consumer Healthcare Czech Republic s.r.o.
12. REGISTRAČNÍ ČÍSLO/ČÍSLA
Reg.č.: 69/220/01-C
13. ČÍSLO ŠARŽE
č. š.:
14. KLASIFIKACE PRO VÝDEJ
15. NÁVOD K POUŽITÍ
Pro dospělé a dospívající od 12 let
Uvolní ucpaný nos
16. INFORMACE V BRAILLOVĚ PÍSMU
17. JEDINEČNÝ IDENTIFIKÁTOR – 2D ČÁROVÝ KÓD
18. JEDINEČNÝ IDENTIFIKÁTOR – DATA ČITELNÁ OKEM